15批次藥品不合規!涉修正藥業集團產婦康片等
人民網北京6月21日電 (記者孫紅麗)國家藥監局近日發布通告,經廣州市藥品檢驗所等8家藥品檢驗機構檢驗,標示為修正藥業集團股份有限公司等15家企業生產的婦康片等15批次藥品不符合規定。
根據通告,經福建省食品藥品質量檢驗研究院檢驗,標示為西安高科陜西金方藥業公司生產的1批次己酮可可堿注射液不符合規定,不符合規定項目為可見異物。
經貴州省食品藥品檢驗所檢驗,標示為四川美大康華康藥業有限公司生產的1批次維生素B6注射液不符合規定,不符合規定項目為可見異物。
據悉,可見異物系指存在于注射劑、眼用液體制劑中,在規定的目視條件下能夠觀察到的不溶性物質,其粒徑或長度通常大于50微米。
經寧夏回族自治區藥品檢驗研究院檢驗,標示為湖北睿澤藥業有限公司委托湖北鑫安康藥業有限公司生產的1批次熊去氧膽酸片不符合規定,不符合規定項目為含量測定(含量測定系指用規定的試驗方法測定原料及制劑中有效成分的含量)。
經廣州市藥品檢驗所檢驗,標示為修正藥業集團股份有限公司生產的1批次婦康片不符合規定,不符合規定項目為微生物限度。
據悉,微生物限度系對非直接進入人體內環境的藥物制劑的微生物控制要求。由于此類藥物制劑的用藥風險略低,可以允許一定數量的微生物存在,但不得檢出一些條件致病菌。微生物限度分為計數檢查和控制菌檢查兩部分。
經成都市藥品檢驗研究院檢驗,標示為河南濟世藥業有限公司、廣西金頁制藥有限公司生產的2批次三黃片不符合規定,不符合規定項目為土大黃苷(土大黃苷主要考察含大黃的藥品中是否存在土大黃的情況)。
經重慶市食品藥品檢驗檢測研究院檢驗,標示為葵花藥業集團湖北武當有限公司委托葵花藥業集團(襄陽)隆中有限公司生產的1批次杏蘇止咳糖漿不符合規定,不符合規定項目為pH值(pH值是氫離子濃度指數,作為酸堿程度的衡量指標)。
經浙江省食品藥品檢驗研究院檢驗,標示為河北全泰藥業有限公司、河北祁新中藥顆粒飲片有限公司、紹興震元中藥飲片有限公司、安徽鴻坤藥業有限公司、山東本草堂中藥飲片有限公司生產的5批次炒酸棗仁不符合規定,不符合規定項目為水分(水分系指藥品中的含水量。水分偏高通常與工藝、包裝不當以及儲運環境等因素有關)。
經寧夏回族自治區藥品檢驗研究院檢驗,標示為成都仁濟宏藥業有限公司、四川光然中藥材飲片有限公司生產的2批次地骨皮不符合規定,不符合規定項目為總灰分。
經河北省藥品醫療器械檢驗研究院檢驗,標示為安國市榮華本草中藥材有限公司生產的1批次茯苓皮不符合規定,不符合規定項目包括總灰分和酸不溶性灰分。
據悉,總灰分測定的目的是檢測中藥的純凈程度。酸不溶性灰分指標主要用于檢測中藥中泥土、沙石等雜質的含量。
國家藥監局表示,對上述不符合規定藥品,藥品監督管理部門已要求相關企業和單位采取暫停銷售使用、召回等風險控制措施,對不符合規定原因開展調查并切實進行整改。國家藥監局要求相關省級藥品監督管理部門依據《中華人民共和國藥品管理法》,組織對上述企業和單位存在的涉嫌違法行為立案調查,并按規定公開查處結果。
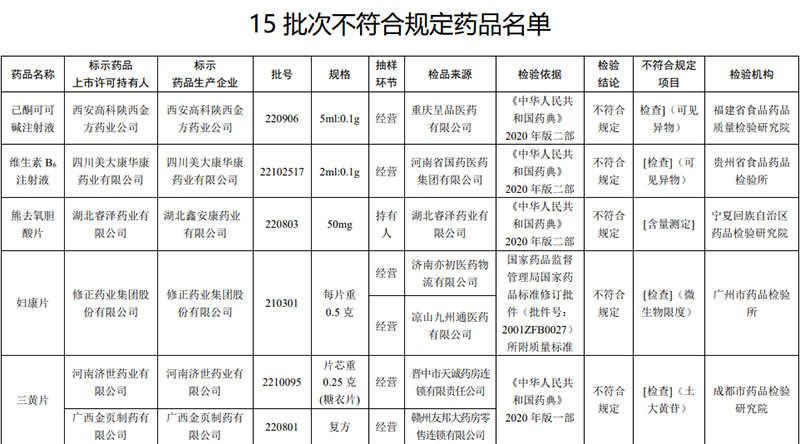
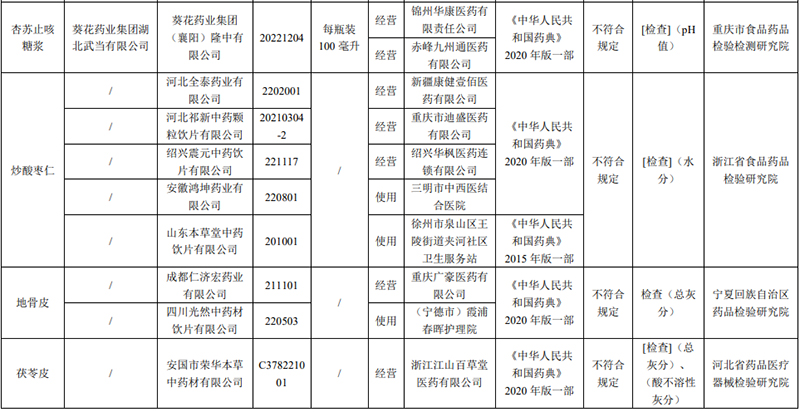
圖表來源:國家藥監局網站截圖
分享讓更多人看到 

































 第一時間為您推送權威資訊
第一時間為您推送權威資訊
 報道全球 傳播中國
報道全球 傳播中國
 關注人民網,傳播正能量
關注人民網,傳播正能量